Caseïne van de E. coli’s (afb: Peter Ruhdal Jensen et al./Cell)
Melk niet van de koe bestaat natuurlijk al en wordt (heb ik=as het idee) vrij driftig gebruikt, maar nu beloven onderzoekers ‘echte’ koemelk te maken zonder dat er een koe aan te pas komt en daar zou het klimaat wel is aardig van kunnen opknappen want koeien vormen en fikse broeikasgasbron (naast andere problemen die de melkproductie veroorzaakt). De alternatieve ‘melkkoe’ is een, genetisch veranderde, bacterie, de bekende Eschericha coli.
Caseïne schijnt een gezocht eiwit te zijn en verreweg het belangrijkste eiwit in koemelk. Nu is caseïne alleen afkomstig van koeien en melkkoeien moeten regelmatig kalven om melk te blijven geven. Dat heeft een belangrijk ‘bijproduct’: kalveren. Wat doe je daarmee?
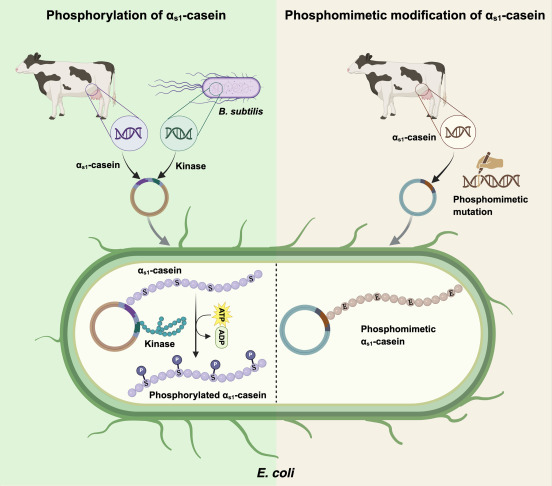
Het schijnt al vaker geprobeerd te zijn koemelk met behulp van genetische veranderde bacteriën te maken. maar voor caseïne is dat fosforyleringsreactie nodig (verbinding met fosfaatgroepen). Dat schijnt problematisch te zijn.
Fosforylering van serineresiduen (aminozuurcomponenten) is cruciaal voor het vermogen van caseïne om calcium te binden, wat melk stabiel maakt en zijn voedingseigenschappen bepaalt. Calciumbinding zorgt ook voor de vorming van eiwitstructuren, caseïnemicellen genaamd, die fungeren als afgiftemiddelen voor biologisch beschikbaar calcium en fosfaat.
Om dat voor elkaar te krijgen hanteerden de onderzoekers rond Peter Ruhdal Jensen van de TU van Denemarken twee belangrijke strategieën. Ze ontwikkelden bacteriën die drie Bacillus subtilis–eiwitkinases aanmaken (coderen voor, eigenlijk). Die genen, zo begrijp ik het, werden aan het DNA. van E. coli’s toegevoegd. Kinases zijn enzymen die de toevoeging van fosfaatgroepen aan eiwitten katalyseren.
Vervolgens ontwierpen ze een alternatieve versie van αs1-caseïne, waarbij serineresiduen – die normaal gesproken gefosforyleerd worden in het natuurlijk voorkomende eiwit- werden vervangen door asparaginezuur om de negatieve lading en functionele effecten van fosforylering na te bootsen.
De onderzoekers voerden allerlei structurele analyses, calciumbindingstesten en gesimuleerde verteringsproeven uit op/met de afgeleide αs1-caseïne. De resultaten gaven aan dat zowel de gefosforyleerde als de alternatieve caseïnen van bacteriële oorsprong een hoog calciumbindend vermogen hadden en dat hun verteerbaarheid en structuur vergelijkbaar waren met die van rundercaseïne.
Koecaseïne
De onderzoekers stellen dat fosforylering via kinases een route biedt voor het nauwkeurig nabootsen van ‘echte’ caseïne van de koe, terwijl de alternatieve caseïne een eenvoudiger route biedt voor de productie van functioneel vergelijkbare eiwitten. Ze stellen ook dat verdere kwantitatieve analyse nodig is om ons vermogen om de microbiële caseïnen voor duurzame en diervriendelijke zuivel- en voedingstoepassingen volledig te benutten.
Bron: phys.org
